Các dạng bài tập hóa 10 chương 2
Phương pháp giải các dạng bài tập chương Bảng tuần hoàn những nguyên tố hóa học
Với phương pháp giải các dạng bài xích tập chương Bảng tuần hoàn những nguyên tố hóa học Hoá học tập lớp 10 tổng hợp những dạng bài xích tập, bài bác tập trắc nghiệm có lời giải cụ thể với đầy đủ cách thức giải, lấy một ví dụ minh họa để giúp đỡ học sinh ôn tập, biết cách làm dạng bài xích tập Bảng tuần hoàn những nguyên tố chất hóa học từ kia đạt điểm cao trong bài thi môn Hoá học lớp 10.
Bạn đang xem: Các dạng bài tập hóa 10 chương 2

Bài tập trắc nghiệm
Xác định tên nguyên tố lúc biết thành phần nguyên tố trong phù hợp chất
Lý thuyết và cách thức giải
Cần nhớ một số điểm sau:
- Hóa trị tối đa với oxi của nhân tố = STT nhóm A.
- Hóa trị với H( ví như có) = 8 - hóa trị cao nhất với oxi.
- % cân nặng của A trong hợp hóa học AxBy là: %A= MA*100/M.
- Muốn xác định nguyên tố sẽ là nguyên tố làm sao cần tìm kiếm được M =?.
Ví dụ minh họa
Ví dụ 1. nhân tố R có hóa trị cao nhất trong oxit cấp 3 lần hóa trị trong hợp chất với hiđro. Hãy cho thấy hóa trị cao nhất của R vào oxit.
Hướng dẫn:
Gọi hóa trị cao nhất của R trong oxit là m, hóa trị vào hợp hóa học với hiđro là n. Ta có: m + n = 8.
Theo bài: m = 3n. Trường đoản cú đây tìm kiếm được m = 6; n = 2.
Ví dụ 2. Một nguyên tố tạo thành hợp hóa học khí với hidro có công thức RH3.Nguyên tố này chiếm 25,93% về cân nặng trong oxit bậc cao nhất. Khẳng định tên nguyên tố.
Hướng dẫn:
Hợp hóa học với Hiđro là RH3 ⇒ Chất tối đa với oxi bao gồm công thức là: R2 O5
Ta bao gồm : (2.R) / (16.5) = 25,93/74,07
⇒ R= 14 ⇒ R là nguyên tố Nitơ
Ví dụ 3. Oxit tối đa của một nguyên tố đựng 72,73% oxi, còn trong hợp chất khí với hidro cất 75% nhân tố đó.Viết công thức oxit cao nhất và hợp chất khi cùng với hidro.
Hướng dẫn:
Gọi hợp chất với hidro bao gồm công thức là : RHx
⇒ Hợp hóa học với oxi bao gồm công thức là R2 Ox-8
Ta có:
(1) (2.R) / 16(8-x )= 27,27/72,73.
(2) R/x = 75/ 25 = 3
⇒ R= 3x thế vào pt(1) ta bao gồm đáp án : x= 4 cùng ⇒ R = 12
Vậy R là cacbon ⇒ CO2 cùng CH4
Ví dụ 4. Oxit cao nhất của nhân tố R thuộc team VIA bao gồm 60% oxi về khối lượng. Hãy xác yếu tắc R và viết công thức oxit cao nhất.
Hướng dẫn:
Nhóm VIA nên hợp chất oxit bậc cao là RO3
Ta có: R/ 48 = 40/60 vậy R= 32 ( lưu giữ huỳnh)
⇒ Công thưc Oxit cao nhất là : SO3
Ví dụ 5. Oxit cao nhất của nhân tố R có dạng R2O5 . Trong hợp chất của R cùng với hiđro sinh hoạt thể khí tất cả chứa 8,82 % hiđro về khối lượng. Cách làm phân tử của hợp chất khí cùng với hiđro là ( C = 12, N= 14, P= 31, S= 32)
A. NH3. B.H2S. C. PH3. D. CH4.
Hướng dẫn:
Oxit cao nhất của R là R2O5 cần R thuộc đội VA.
⇒ Hợp hóa học với H là RH3
Ta có 3/R = 8,82 / 91,18 ⇒ R=31 (P)
⇒ lựa chọn C
B. Bài xích tập trắc nghiệm
Câu 1. Oxit tối đa của một nguyên tố ứng với cách làm R2O5. Hợp hóa học của nó cùng với hidro là 1 chất tất cả thành phần không đổi với R chiếm 82,35% với H chỉ chiếm 17,65% về khối lượng. Tìm nguyên tố R.
Lời giải:
Nguyên tố tất cả oxit tối đa là R2O5 → R thuộc team VA.
→ Hợp hóa học với hidro: RH3
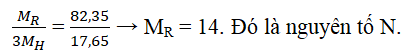
Câu 2. Oxit tối đa của một nguyên tố ứng với bí quyết RO3. Hợp hóa học của nó cùng với hidro tất cả 5,88% H về khối lượng. Xác định R.
Lời giải:
Oxit cao nhất là RO3 → R thuộc team VIA.
Hợp hóa học với hidro tất cả dạng RH2.
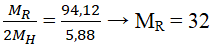
Đó là nguyên tố lưu hoàng (S).
Câu 3. Một yếu tố Q sinh sản hợp chất khí cùng với hiđro tất cả công thức QH3. Yếu tố này chiếm 25,93% theo cân nặng trong oxit bậc cao nhất. Định tên thành phần Q.
Lời giải:
Từ hợp hóa học QH3 ⇒ Q tất cả hóa trị III
⇒ Hợp hóa học oxit tối đa lầ: Q2O5.
Theo đề bài, ta có: %Q = 2Q/(2Q + 80) × 100 = 25,93
⇔ Q + 40 = 3,875Q ⇒ Q = 14: Nitơ
Câu 4. Oxit cao nhất của nguyên tố R có dạng R2O7. Sản phầm khí của R với hidro đựng 2,74% hidro về khối lượng. Khẳng định nguyên tử khối của R.
Lời giải:
Oxit cao nhất của thành phần R tất cả công thức R2O7.
→ bí quyết hợp chất khí với hidro gồm dạng RH theo đề:
%H = 1/(R+1) . 100% = 2,74%
Giải ra ta có: R = 35,5 (clo). Cl
→ công thức phân tử của oxit là Cl2O7
Công thức hợp chất khí cùng với hidro là HCl.
Câu 5. Tỉ số phần trăm của nguyên tố R trong oxit bậc cao nhất với tỷ lệ của R trong hợp hóa học khí với hiđro là 0,6994. R là yếu tố phi kim ở đội lẻ. Xác định R.
Lời giải:
Đặt oxit cao nhất có dạng R2On (X)
Hợp chất khí cùng với hiđro bao gồm dạng RH8-n (Y)
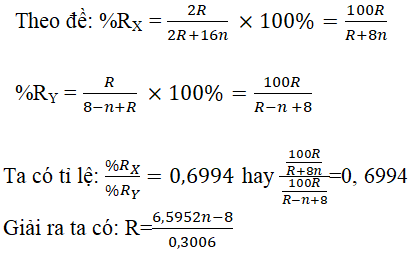
Vì R là yếu tố phi kim ở nhóm lẻ đề xuất n = 5 hoặc n = 7
| n | 5 | 7 |
| R | 83,07 (loại) | 127 (nhận) |
R là iot (I) ⇒ phương pháp oxit cao nhất: I2O7; hợp hóa học khí : HI
Câu 6. Nguyên tử Y có hóa trị tối đa với oxi cấp 3 lần hóa trị vào hợp hóa học khí cùng với hidro. Call X là phương pháp hợp hóa học oxit cao nhất, Z là công thức hợp hóa học khí với hidro của Y. Tỉ khối hơi của X so với Z là 2,353. Khẳng định nguyên tố Y.
Lời giải:
Gọi hóa trị cao nhất với H là nH cùng với oxi là nO.
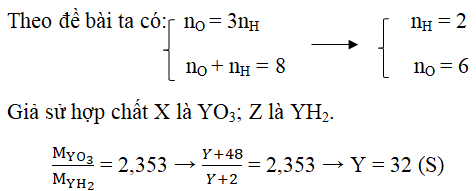
Câu 7. Hợp hóa học khí cùng với hiđro của một yếu tố ứng với cách làm RH4. Oxit tối đa của nó cất 53,3% oxi theo khối lượng. Khẳng định tên nhân tố R.
Lời giải:
Từ phương pháp RH4 ⇒ R có hóa trị IV
⇒ công thức oxit tối đa của R là: RO2
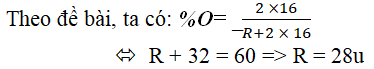
Vậy nhân tố R là silic (Si).
Câu 8. Nguyên tử của nguyên tố C có cấu hình electron lớp ngoài cùng là ns2np4. Vào hợp hóa học khí của X với hidro, X chiếm 94,12% khối lượng. Phần trăm cân nặng của yếu tố X vào oxit tối đa là:
A.50,00%B.27,27%C.60,00%D.40,00%
Lời giải:
X: ns2np4 → X thuộc đội IVA → hợp hóa học khí với H là XH2
→ oxit cao nhất là XO3.
Mối quan hệ nam nữ giữa cấu hình e và vị trí, cấu tạo
A. Phương pháp & Ví dụ
Lý thuyết và cách thức giải
Cần nhớ :
- Số vật dụng tự ô nhân tố = tổng thể e của nguyên tử.
- Số thiết bị tự chu kì = số lớp e.
- Số trang bị tự nhóm:
+ Nếu thông số kỹ thuật e phần ngoài cùng có dạng nsanpb (a = 1 → 2 cùng b = 0 → 6): thành phần thuộc team (a + b)A.
+ Nếu thông số kỹ thuật e ngừng ở dạng (n - 1)dxnsy(x = 1 → 10; y = 1 → 2): thành phần thuộc đội B:
* team (x + y)B ví như 3 ≤ (x + y) ≤ 7.
* đội VIIIB nếu 8 ≤ (x + y) ≤ 10.
* nhóm (x + y - 10)B nếu như 10
Ví dụ minh họa
Ví dụ 1. Xác xác định trí (số máy tự, chu kỳ, nhóm, phân nhóm) các nguyên tố dưới đây trong bảng tuần hoàn, mang lại biết thông số kỹ thuật electron của nguyên tử những nguyên tố kia như sau:
1. 1s22s22p63s23p64s2 2. 1s22s22p63s23p63d54s2
Hướng dẫn:
1. Số sản phẩm tự 20, chu kì 4, nhóm IIA.
2. Số lắp thêm tự 25, chu kì 4, team VIIB.
Ví dụ 2. trả sử yếu tố M làm việc ô số 19 vào bảng tuần hoàn chưa được tìm ra cùng ô này vẫn còn được quăng quật trống. Hãy dự kiến những điểm lưu ý sau về thành phần đó:
a. Tính chất đặc trưng.
b. Bí quyết oxit. Oxit chính là oxit axit tốt oxit bazơ?
Hướng dẫn:
a, cấu hình electron của nguyên tố kia là: 1s22s22p63s23p64s1
⇒ Electron phần ngoài cùng là một nên đặc điểm đặc trưng của M là tính kim loại.
b, yếu tố đó nằm tại nhóm IA nên công thức oxit là M2O. Đây là một trong những oxit bazơ.
Ví dụ 3. Ion M3+có cấu hình electron lớp bên ngoài cùng là 3s23p63d5.
a, Xác xác định trí (số lắp thêm tự, chu kỳ, nhóm) của M vào bảng tuần hoàn. Cho biết thêm M là sắt kẽm kim loại gì?
b, vào điều kiện không có không khí, cho M cháy vào khí Cl2 thu được một hóa học A và nung các thành phần hỗn hợp bột (M cùng S) được một hợp hóa học B. Bằng những phản ứng hóa học, hãy nhận ra thành phần với hóa trị của những nguyên tố trong A và B.
Hướng dẫn:
a, tổng số electron của nguyên tử M là 26. Số thứ tự 26, chu kì 4, team VIIIB. M là Fe.
b, fe cháy trong khí clo:
2Fe + 3Cl2 → 2FeCl3
Hòa tan thành phầm thu được vào nước nhận được dung dịch. đem vài ml dung dịch cho tác dụng với hỗn hợp AgNO3, tất cả kết tủa trắng chứng tỏ có gốc clorua:
FeCl3 + 3AgNO3 → Fe(NO3 ) 3 + 3AgCl
Lặp lại thể nghiệm với hỗn hợp NaOH, bao gồm kết tủa nâu đỏ chứng tỏ có Fe(III):
FeCl3 + 3NaOH → Fe(OH) 3 + 3NaCl
- Nung tất cả hổn hợp bột Fe cùng bột S:
sắt + S → FeS
Cho B vào dung dịch H2 SO4 loãng, gồm khí mùi trứng thối bay ra chứng tỏ có cội sunfua:
FeS + H2 SO4 → FeSO4 + H2 S (trứng thối)
Nhỏ dung dịch NaOH vào dung dịch thu được, bao gồm kết tủa trắng xanh chứng minh có Fe(II):
FeSO4 + 2NaOH → Na2 SO4 + Fe(OH) 2 (trắng xanh)
Ví dụ 4. Ở tâm lý cơ bản, cấu hình electron phần ngoài cùng của nguyên tử X là 3s2. Số hiệu nguyên tử của nhân tố X là
A. 12. B. 13. C. 11. D. 14.
Hướng dẫn:
Ở trạng thái cơ bản, thông số kỹ thuật electron phần ngoài cùng của nguyên tử X là 3s2
Cấu hình e của X là: 1s22s22p63s2
X gồm 12 e nên gồm 12 p. Nên số hiệu nguyên tử của nhân tố X là 12.
⇒ lựa chọn A
Ví dụ 5. cho thấy tổng số electron trong anion AB32-là 42. Trong số hạt nhân A và B đều sở hữu số proton ngay số nơtron.
a. Search số khối của A cùng B
b. Cho thấy vị trí của A, B vào bảng tuần hoàn
Hướng dẫn:
a. Hotline số hạt proton của A là p. Và của B là P’, ta có:
P + 3P’ = 42 - 2. Ta thấy 3P’ 32- -: loại
Nếu B là oxi (P’ = 8) → p = 16 (S). Anion là SO32- -: thỏa mãn
Nếu B là flo (P’ = 9) → phường = 13 (Al). Anion là AF32- -: loại
Vậy A là lưu huỳnh, B là oxi.
b. O (P’ = 8) : 1s22s22p4 ⇒ ô số 8, chu kỳ 2, nhóm VIA.
S (P = 16) : 1s22s22p63s23p4 ⇒ ô số 16, chu kỳ 3, đội VIA.
Ví dụ 6. Nguyên tử R tạo ra Cation R+. Cấu hình e của R+ở tâm trạng cơ bạn dạng là 3p6. Tổng cộng hạt có điện vào R là.
A.18 B.22 C.38 D.19
Hướng dẫn:
Cấu hình của R+là 3p6
⇒ R sẽ là 3p64s1
⇒ R có cấu hình đầy đầy đủ là 1s22s22p63s23p64s1
⇒ Tổng hạt mang điện vào R là ( phường + e ) = 38
⇒ chọn C
Ví dụ 7. Một thích hợp chất có công thức XY2 trong những số ấy X chiếm một nửa về khối lượng. Trong hạt nhân của X cùng Y đều phải có số proton bằng số notron. Tổng thể proton vào phân tử XY2 là 32.
a. Viết cấu hình electron của X cùng Y.
b. Xác xác định trí của X và Y vào bảng tuần hoàn.
Hướng dẫn:
a. điện thoại tư vấn số phân tử prroton, nơtron, electron của nguyên tử X là P, N, E và của Y là P’, N’, E’.
Theo bài: p. = N = E với P’ = N’ = E’ ⇒ Mx = 2P, My = 2P’
Trong hợp hóa học XY2, X chiếm 1/2 về trọng lượng nên:
Mx /(2. My )= 50/50 =1 ⇒ 2P /2.2P’ =1 ⇒ p. = 2P’.
Tổng số proton trong phân tử XY2 là 32 nên p + 2P’ = 32.
⇒ phường = 16 (S) cùng P’ = 8 (O). ⇒ thích hợp chất buộc phải tìm là SO2.
Cấu hình electron của S: 1s22s22p63s23p4 với của O: 1s22s22p4
b. Sulfur ở ô số 16, chu kỳ 3, nhóm VIA.
Oxi sinh hoạt ô số 8, chu kỳ luân hồi 2, team VIA.
Ví dụ 8. Cho biết thông số kỹ thuật electron phần bên ngoài cùng của nguyên tử các nguyên tố (thuộc chu kỳ luân hồi 3) A, M, X theo lần lượt là ns1, ns2np1, ns2np5. Xác xác định trí của A, M, X trong bảng tuần trả và cho thấy thêm tên của chúng.
Hướng dẫn:
A, M, X thuộc chu kỳ luân hồi 3 buộc phải n = 3.
Cấu hình electron, vị trí với tên nguyên tố:
A: 1s22s22p63s1(ô số 11, nhóm IA), A là sắt kẽm kim loại Na.
M: 1s22s22p63s23p1(ô số 13, nhóm IIIA), M là kim loại Al.
X: 1s22s22p63s23p5(ô số 17, team VIIA), X là phi kim Cl.
B. Bài bác tập trắc nghiệm
Câu 1. cho những nguyên tố có thông số kỹ thuật electron như sau:
1s22s22p2, 1s22s22p5, 1s22s22p63s23p6, 1s22s22p63s1
a) xác định số electron hóa trị của từng nguyên tử.
b) Xác định vị trí của chúng (chu kì, nhóm, phân team trong bảng tuần hoàn các nguyên tố hóa học).
Lời giải:
Đáp án:
a) xác minh số electron hóa trị:
1s22s22p2: tất cả 4 electron hóa trị.
Xem thêm: Ớt Bột Hàn Quốc Là Gì ? Mua Ớt Bột Hàn Quốc 1Kg Ớt Bột Hàn Quốc 1Kg
1s22s22p5: gồm 7 electron hóa trị.
1s22s22p63s23p6: gồm 8 electron hóa trị.
1s22s22p63s1: có một electron hóa trị.
b) Xác định vị trí của những nguyên tố trong bảng tuần hoàn:
1s22s22p2: Nguyên tố nằm trong chu kì 2, đội IVA
1s22s22p5: Nguyên tố thuộc chu kì 2, team VIIA
1s22s22p63s23p6: Nguyên tố trực thuộc chu kì 3, nhóm VIIIA
1s22s22p63s1: Nguyên tố thuộc chu kì 3, đội IA
Câu 2. cho các hạt vi mô X+, Y- , Z2- với Q có thông số kỹ thuật electron: ls22s22p6. Xác định vị trí những nguyên tố X, Y, Z cùng Q trong bảng tuần hoàn các nguyên tố hóa học.
Lời giải:
Đáp án:
- thành phần Q cấu hình electron: ls22s22p6 yêu cầu Z = 10 là yếu tố khí hiếm thuộc ô sản phẩm 10, chu kì 2 đội VIIIA.
- Cation X+ có mặt do: X → X+ + 1e phải Z = 11; X bao gồm cấu electron: ls22s22p63s1. Vậy X sinh hoạt ô máy 11, chu kì 3 team IA.
- Anion Y- có mặt do: Y + 1e →Y- đề xuất Z = 9; Y có thông số kỹ thuật electron: ls22s22p6. Vậy Y ngơi nghỉ ô thứ 9, chu kì 2 đội VIIA.
- Anion Z2- sinh ra do: Z + 2e→ Z2- nên Z = 8. Z có thông số kỹ thuật electron: ls22s22p4. Vậy Z ngơi nghỉ ô sản phẩm công nghệ 8, chukì 2 đội VIA.
Câu 3. Một nguyên tố sinh hoạt chu kì 2, đội VA trong bảng tuần hoàn các nguyên tố hóa học. Hỏi:
a.Nguyên tử của yếu tắc đó bao gồm bao nhiên electron ở lớp bên ngoài cùng?
b.Các electron ngoại trừ cùng nằm ở lớp lắp thêm mấy?
c.Viết cấu hình electron nguyên tử của nhân tố trên?
Lời giải:
Đáp án:
a) vày thuộc team VA đề xuất nguyên tố gồm 5 electron ở phần ngoài cùng.
b) bởi vì thuộc chu kì 2 nên các electron ko kể cùng nằm ở lớp sản phẩm hai.
c) thông số kỹ thuật electron: 1s22s22p3
Câu 4. Xác xác định trí của nguyên tố có Z = trăng tròn và nguyên tố bao gồm Z = 29.
Lời giải:
Đáp án:
- cùng với nguyên tố bao gồm Z = trăng tròn thì cấu hình electron: 1s22s22p63s23p64s2 trong bảng tuần hoàn nguyên tố kia ở
+) Ô thứ 20.
+) Chu kì 4: vì tất cả 4 lớp electron.
+) đội IIA vì tất cả 2 electron cuối cùng chiếm obitan 4s2 ở lớp bên ngoài cùng.
- với nguyên tố gồm Z = 29 thì cấu hình electron: 1s22s22p63s23p63d104s1 trong bảng tuần trả nguyên tố kia ở.
+) Ô vật dụng 29.
+) Chu kì 4 vì bao gồm 4 lớp electron.
+) team IB vì bao gồm electron ứng với tầm năng lượng tối đa chiếm obitan 3d; tổng số electron làm việc (n - l)d với ns là 11 cần thuộc team 11 - 10 = 1.
Câu 5. Biết thành phần R trực thuộc chu kì 2 đội VA của bảng tuần hoàn. Hãy viết thông số kỹ thuật electron của nguyên tử R.
Lời giải:
Đáp án:
E nằm trong chu kì 2 ⇒ bao gồm 2 lớp electron. R thuộc team VA ⇒ gồm 5 electron phần ngoài cùng ⇒ cấu hình electron của R: ls32s22p3.
Câu 6. Một yếu tố có thông số kỹ thuật electron nguyên tử như sau:
1s22s22p4;1s22s22p3;
1s22s22p63s23p1;1s22s22p63s23p5.
a) Hãy xác minh số electron hóa trị của từng nguyên tố.
b) Hãy xác xác định trí của bọn chúng (chu kì, nhóm) trong bảng tuần hoàn các nguyên tố hóa học.
Lời giải:
Đáp án:
a) số electron hóa trị của từng nguyên tố:
+) 1s2 2s2 2p4: bao gồm 6 electron hóa trị.
+) 1s2 2s2 2p3: có 5 electron hóa tri
+) 1s2 2s2 2p6 3s2 3p1: bao gồm 3 electron hóa trị
+) 1s2 2s2 2p6 3s2 3p5: gồm 7 electron hóa trị
b) Ví trí (chu kỳ, nhóm) cửa các nguyên tố:
Dựa vào thông số kỹ thuật electron của nguyên tử cho biết:
Số lớp electron suy ra số thiết bị tự của chu kì.
Các electron phần bên ngoài cùng là electron s với electron p. Nên chúng số đông là nhân tố p, thế nên chúng thuộc team A, chính vì như vậy số electron kế bên cùng cho thấy thêm số trang bị tự của nhóm.
+) 1s2 2s2 2p4: trực thuộc chu kì 2, nhóm VIA.
+) 1s2 2s2 2p3: trực thuộc chu kì 2, đội VA.
+) 1s2 2s2 2p6 3s2 3p1: thuộc chu kì , nhóm IIIA
+) 1s2 2s2 2p6 3s2 3p5: ở trong chu kì 3, nhóm VIIA
Câu 7. Nguyên tử X, anion Y-, cation Z- hầu hết có thông số kỹ thuật electron ở phần bên ngoài cùng là 4s24p6. Cho biết vị trí (chu kì, nhóm) và đặc điểm (phi kim hay kim loại) của X, Y, Z trong bảng khối hệ thống tuần hoàn.
Lời giải:
Đáp án:
Từ thông số kỹ thuật electron ở lớp bên ngoài cùng là 4s24p6 suy ra cấu hình electron không thiếu là: ls22s22p63s23p63d104s24p6.
+) thành phần X: ls22s22p63s23p63d104s24p6.
Thuộc chu kì 4, nhóm VIIIA; có 8e lớp bên ngoài cùng X là khí hiếm.
+) nhân tố Y: tự Y + 1e = Y-
Nên thông số kỹ thuật của Y là: ls22p22p63s23p63d104s24p6, thuộc chu kì 4, nhóm VIIA; gồm 7e phần bên ngoài cùng ⇒ Y là phi kim.
+) thành phần Z: tự z = z+ + le
Nên cấu hình của z là: 1s22s22p63s23p63d104s24p65s1, trực thuộc chu kì 5, đội IA; bao gồm 1e phần bên ngoài cùng z là kim loại.
Câu 8. Cation (ion dương) X+ có thông số kỹ thuật electron sinh sống phân lớp ngoài cùng là 2p6.
a) Viết thông số kỹ thuật electron với sự phân bố electron theo obitan của thành phần X.
b) cho biết thêm vị trí của X.
Lời giải:
Đáp án:
a) Viết thông số kỹ thuật electron và sự phân bổ electron vào obitan.
Vì cation X+ là do nguyên tử X thiếu tính 1 electron nên thông số kỹ thuật electron của X: 1s22s22p62s2 3s1 với sự phân bố các obitan như sau:
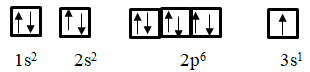
b) X nằm trong chu kì 3 vì bao gồm 3 lớp electron.
X thuộc đội IA vì có 1 electron ở lớp bên ngoài cùng.
X ở trong ô 11 vì gồm tổng điện tích 11.
Bài tập về sự biến thiên bẩm chất của các nguyên tố hóa học
A. Cách thức & Ví dụ
Lý thuyết và phương pháp giải
Dựa vào quy luật biến thiên đặc thù theo chu kì cùng theo nhóm.
- trong chu kì: theo chiều tăng của diện tích hạt nhân (tức Z tăng): tính sắt kẽm kim loại giảm, phi kim tăng, tính bazơ giảm, axit tăng.
- Trong đội A: theo chiều Z tăng: Tính kim loại tăng, phi kim giảm, tinh bazơ tăng, tính axit giảm.
Ví dụ minh họa
Ví dụ 1. Dãy những nguyên tố nào dưới đây được sắp xếp theo chiều tăng đột biến tính kim loại?
A. Li, Be, Na, K. B. Al, Na, K, Ca.
C. Mg, K, Rb, Cs. D. Mg, Na, Rb, Sr.
Hướng dẫn:
Trong 1 chu kì, tính sắt kẽm kim loại giảm dần dần (đi từ bỏ trái qua phải).
Trong 1 nhóm, tính kim loại tăng ngày một nhiều (đi từ bên trên xuống dưới).
Do đó dãy sắp xếp tăng dần tính kim loại là: Mg, K, Rb, Cs
⇒ lựa chọn C
Ví dụ 2. cho các nguyên tố X, Y, Z với số hiệu nguyên tử theo lần lượt là 4, 12, 20. Tuyên bố nào sau đây sai?
A. Những nguyên tố này rất nhiều là những kim loại vượt trội nhất trong chu kì.
B. Các nguyên tố này không cùng trực thuộc 1 chu kì.
C. Thứ tự tăng dần đều tính bazo là: X(OH)2, Y(OH) 2, Z(OH) 2
D. Lắp thêm tự tăng dần độ âm năng lượng điện là: Z x= 4 ⇒ thông số kỹ thuật e lớp bên ngoài cùng của X là … 2s2 ⇒ X thuộc team II, chu kì 2
Zy = 12 ⇒ thông số kỹ thuật e lớp ngoài cùng của Y là ….3s2 ⇒ Y thuộc đội II, chu kì 3
Zz = 20 ⇒ cấu hình e lớp bên ngoài cùng của Z là ….4s2⇒ Z thuộc đội II, chu kì 4
A sai do nguyên tố đội IA mới là KL vượt trội nhất trong 1 CK
B đúng X thuộc ck 2, Y thuộc ông xã 3, Z thuộc ông chồng 4.
C đúng Trong thuộc 1 đội tính bazo tăng ngày một nhiều theo chiều tăng vọt của năng lượng điện hạ nhân.
D đúng Trong thuộc 1 nhóm độ âm điện bớt dần theo chiều tăng nhiều của điện tích hạt nhân.
⇒ lựa chọn A
Ví dụ 3. Cho các phát biểu sau:
(I) F là phi kim to gan lớn mật nhất.
(II) Li là KL gồm độ âm điện mập nhất
(III) He là nguyên tử có bán kính nhỏ tuổi nhất.
(IV) Be là KL yếu độc nhất trong đội IIA.
Số những phát biểu đúng là?
A. 1 B. 2 C. 3 D. 4
Hướng dẫn:
⇒ chọn C (I, III, IV).
Ví dụ 4. Cho 3 yếu tắc X, Y, Z lần lượt ở chỗ 11, 12, 19 của bảng tuần hoàn. Hidroxit của X, Y, Z tương xứng là X’, Y’, Z’. Trang bị tự tăng mạnh tính bazo là:
A. X’ X = 11 có cấu hình e phần ngoài cùng là 3s1
ZY = 11 có cấu hình e phần bên ngoài cùng là 3s2
ZZ = 19 có cấu hình e lớp bên ngoài cùng là 4s1
Trong thuộc 1 team tính kim loại tăng vọt theo chiều tăng của điện tích hạt nhân vì vậy tính bazo tương ứng của X’ Y’
⇒ lựa chọn B
B. Bài xích tập trắc nghiệm
Câu 1. Tính kim loại tăng dần đều trong dãy :
A. Ca, K, Al, Mg B. Al, Mg, Ca, K
C. K, Mg, Al, Ca D. Al, Mg, K, Ca
Lời giải:
Đáp án: B
Câu 2. Tính phi kim bớt dần trong hàng :
A. C, O, Si, N
B. Si, C, O, N
C. O, N, C, say đắm
D. C, Si, N, O
Lời giải:
Đáp án: C
Câu 3. Tính bazơ tăng dần đều trong dãy :
A. Al(OH)3 ; Ba(OH)2; Mg(OH)2
B. Ba(OH)2; Mg(OH)2; Al(OH)3
C. Mg(OH)2; Ba(OH)2; Al(OH)3
D. Al(OH)3; Mg(OH)2; Ba(OH)2
Lời giải:
Đáp án: D
Câu 4. Tính axit tăng nhiều trong hàng :
A. H3PO4; H2SO4; H3AsO4B. H2SO4; H3AsO4; H3PO4
C. H3PO4; H3AsO4; H2SO4D. H3AsO4; H3PO4 ;H2SO4
Lời giải:
Đáp án: D
Câu 5. Bán kính nguyên tử những nguyên tố : Na, Li, Be, B. Xếp theo chiều tăng ngày một nhiều là:
A. B 2 gồm tính bazơ yếu rộng Ca(OH)2 vị Mg với Ca những thuộc đội IIA, theochiều từ trên xuống, trong một tổ A tính sắt kẽm kim loại tăng dần, tính phi kim loại giảm dần. Đồng thời tính axit của hiđroxit giảm dần, tính bazơ tăng dần.
b) Mg(OH)2 có tính bazơ yếu rộng NaOH bởi Mg và Na hầu như thuộc và một chu kì theo hướng từ trái sang cần tính kim loại giảm dần, tính phi kim tăng dần. Đồng thời axit của hiđroxit tăng dần, tính bazơ giảm dần.
Câu 9.
Hãy so sánh tính chất axit của các chất trong những cặp sau với giải thích: Axit cacbonic với axit silicic; axit photphoric và axit sunfuric; axit silisic và axit sunfuric.
Lời giải:
Đáp án:
- Trong một đội A, lúc đi từ trên xuống tính bazơ của các oxit với hiđroxit tăng dần, tính axit giảm dần. Cần H2CO3 có tính axit bạo phổi hơn H2SiO3.
- trong một chu kì tính bazơ bớt dần với tính axit của các oxit cùng hiđroxit tăng khi đi từ đầu chu kì cho đến cuối chu kì. Bắt buộc tính axit của H2SO4 khỏe khoắn hơn H3PO4
- Tính axit của H2SiO3 yếu hơn H3PO4 (trong 1 chu kì) và H3PO4 yếu rộng H2SO4 vì thế tính axit của H2SiO3 yếu hơn H2SO4











